مقدمه
جدول تناوبی عنصرها به جرئت حکم جواز
ورود به دنیای شیمی را دارد. هر کس به اطلاعات و روش استفاده از آن آگاه باشد میتواند در قلمرو شیمی
بماند و به مطالعه ادامه دهد چرا که بهعنوان سندی محکم، ماهیت شیمی را یکتنه به نمایش میگذارد. به یقین کسب
چنین اعتباری نه تصادفی بهنظر میرسد و نه شگفتانگیز: اگر تنها نگاهی به گذرگاههای تاریخی شکلگیری این جدول داشته باشیم.
جدول تناوبی خانه عنصرهاست که شمار
ساکنان آن اکنون به 120 میرسد. پس میتوان مجسم کرد سرگذشت این جدول ـ که شرح مفصلی از داستان کشف
هر یک از این عنصرها را در بر میگیرد ـ میتواند چه کتاب قطوری باشد. البته زمان دقیق شناخت برخی عنصرها
مشخص نیست، برای نمونه، انسان با طلا، نقره، قلع، مس، سرب و جیوه از زمانهای بسیار دور آشنا
بوده است. نخستین عنصری که با تکیه به روشهای علمی کشف شده فسفر بود که در سال
1649 توسط هنینگ براند1 معرفی شد. در خلال 200 سال پس از این کشف، عنصرهای جدید به
سرعت به عرصه معلومات شیمیدانان پا نهادند که از پیشرفت در استفاده از روشهای تجزیه و هنر
تشخیص مواد شیمیایی نتیجه میگرفت.[3] در دهه نخست قرن نوزدهم، سر همفری دیوی به تنهایی و
با کمک برقکافت، موفق به شناسایی 6 عنصر شد. برزیلیوس نیز 4 عنصر دیگر را کشف کرد
و تا سال 1830، 55 عنصر شناخته شدند. این رشد بیسابقه، کار بررسی خواص فیزیکی و شیمیایی
را برای شیمیدانان
دشوار کرده بود. بنابراین دیری نگذشت که ضرورت طبقهبندی عنصرها بیش از هر زمان دیگری به
میان آمد. چنین بود که در مدت یک قرن و نیم برای طبقهبندی عنصرها، جدولهای متعددی حتی از سوی دانشمندان حوزههای علمی دیگر ارائه شد. این جدولها در گذر زمان و بهطور غیرمستقیم، معرفی
سامانه تناوبی را زمینهسازی کردند. بنابراین جدول تناوبی امروزی
عنصرها را باید حاصل تلاش دانشمندان بیشماری دانست که نام برخی از آنان با این
جدول، در هم تنیده شده است در حالی که از برخی دیگر، هیچ نامی به میان نمیآید.

امضای پدر شیمی مدرن پای نخستین طبقهبندی
آنتوان لاووازیه که صاحب نخستین کتاب در
شیمی مدرن شناخته میشود،
در سال 1789، 33 عنصر شناخته شده تا آن زمان را در این کتاب فهرست کرد و آنها را در چهار گروه
شامل گازها، نافلز، فلز و خاک قرار
داد.[4] لاووازیه با این اقدام برای نخستینبار در زمینه طبقهبندی عنصرها گام برداشت در حالی که هنوز
هیچ تعریفی از مفهوم تناوبی بودن خواص، به میان نیامده بود. در واقع، میتوان فعالیت دانشمندان برای طبقهبندی عنصرها را به دو دوره تقسیم کرد. در دوره نخست که حدود
نیمقرن
بهطول
انجامید طبقهبندیها بر قاعده تناوبی
پایهگذاری
نشده بود. فعالیتهای
جان دالتون و جاکوب برزیلیوس نیز در همین دوره به معرفی و اصلاح نمادهای شیمیایی
برای عنصرها اختصاص داشت.
در سال 1803، دالتون نظریه اتمی جدید را
در کتاب خود ارائه داد. از آنجا که توضیح این نظریه با نمادهای کیمیاگران ممکن
نبود، دالتون نمادهای جدیدی بهصورت حرفهایی درون یک دایره برای عنصرها تعریف کرد، شکل 4- آ.
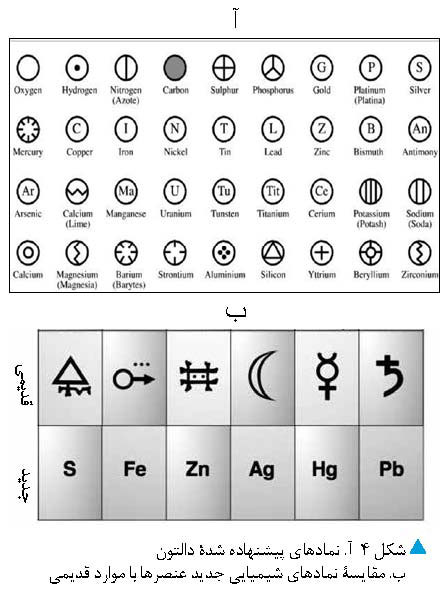
به خاطر سپردن این نمادها دشوار بود و
نسبت به نمادهای قبلی چندان بهتر به نظر نمیرسید اما مشخص میکرد که در یک ترکیب، چه عنصرهایی وجود
دارد.
در سال 1828 برزیلیوس پیشنهاد کرد از
حرف اول (یا دو حرف اول) نام لاتین هر عنصر برای نمایش آن استفاده شود. به این
ترتیب نمادهای جدید عنصرها مشخص شد که کار نوشتن آنها را راحتتر میکرد.[4] این شیوه نمادگذاری تا امروز
کاربرد خود را حفظ کرده است.
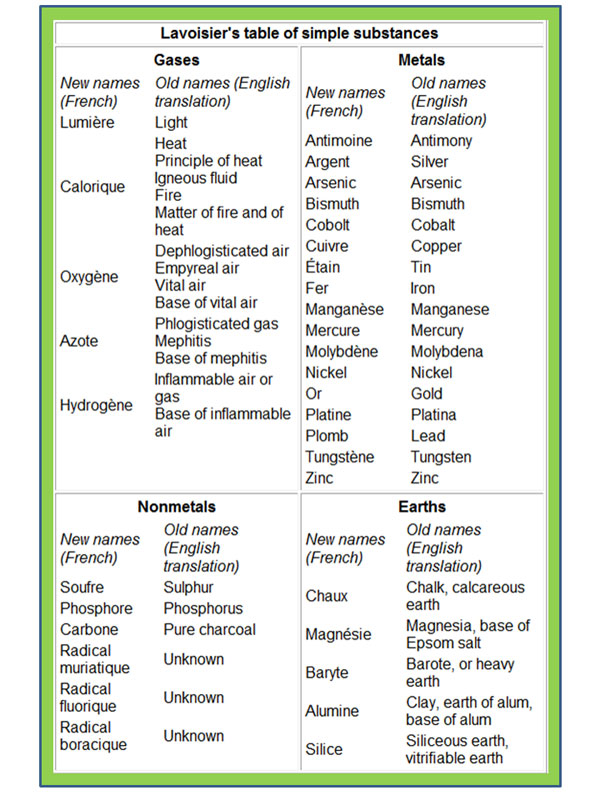
جدول طبقه بندی لاوازیه
قانون سهتایی
در سال 1817 واقعهای روی داد که شیمیدانان را یک گام به
کشف قانون تناوبی نزدیکتر کرد. جان ولفگانگ دوبراینر2، شیمیدان آلمانی، متوجه شد جرم اتمی
استرانسیم برابر با میانگین جرمهای اتمی دو عنصر کلسیم و باریم است؛ رابطهای میان سه عنصر که
خواص شیمیایی یکسانی داشتند. وی پس از مشاهده همین ارتباط، میان سه هالوژن Cl-Br-I و سه فلز قلیایی Li-Na-K،
قانون سهتایی3
را به این ترتیب تعریف کرد:
«اگر سه عنصر به ترتیب جرم اتمی ردیف
شوند، خواص عنصر میانی، میانگینی از خواص دو عنصر دیگر این مجموعه است.»
این دیدگاه مبنای بررسیهای گستردهای قرار گرفت و در
فاصله سالهای
1829 تا 1858 دانشمندان دیگری از جمله ژان باپتیست دوماس4، لئوپولد
گملین5، ارنست لنسن6، ماکس فون پتنکوفر7 و
جی.پی.کوک8 اعلام کردند که این رابطه در مجموعههای دیگر با بیش از سه عضو هم دیده میشود. در همین مدت
فلوئور به گروه هالوژنها افزوده شد. همچنین گروه O-S-Se-Te
و گروه N-P-As-Sn-Bi بهعنوان یک خانواده در
نظر گرفته شدند. بنابراین با اینکه طرح قانون سهتایی اعتباری بهدست نیاورد ولی دانشمندان را به سوی ایده
تناوبی بودن خواص، بهعنوان تابعی از جرم اتمی عنصرها هدایت کرد.
معرفی نخستین جدول تناوبی
سال 1862 بود؛ هفت سال پیش از ارائه
جدول تناوبی مندلیف که برای نخستین بار از مفهوم تناوبی در یک جدول استفاده شد.
افتخار طرح این جدول به نام یک زمینشناس فرانسوی، یعنی الکساندر امیل بگوئر دو شانکورتوس9
ثبت شده است. وی در سطح جانبی یک استوانه، 16 خط موازی با محور آن، در فاصلههای یکسان رسم کرد در
حالیکه
یک خط مارپیچی، با زاویه 45درجه نسبت به محور استوانه، آنها را قطع میکرد. شانکورتوس عنصرها را به ترتیب
افزایش جرم اتمی روی خط مارپیچ قرار داد.[1] بهطور شگفتانگیز، نمودار مارپیچی حاصل، شباهت میان
عنصرهایی را نشان میداد
که جرم اتمیشان
به اندازه ضریبی از 16 با هم تفاوت داشت، روی یک خط عمودی واحد قرار میگرفتند و خواص مشابهی
از خود به نمایش میگذاشتند.
شانکورتوس نتیجهگیری
کرد که عدد مربوط به جرم اتمی عنصرهاست که خواص آنها را تعیین میکند. وی این جدول را جدول تلوری نامید
زیرا عنصر تلور در میان این جدول جای گرفته بود.
قانون اوکتاو
دو سال پس از معرفی جدول تلوری، جان
نیولندز10 بار دیگر 56 عنصر شناخته شده در آن زمان را به ترتیب افزایش
جرم اتمی، چنان طبقهبندی
کرد که براساس خواص فیزیکی مشابه، در 11 گروه قرار گیرند. او متوجه شد اگر مجموعههایی شامل هشت عنصر
پیدرپی
در این ترتیب در نظر گرفته شوند، عنصرهایی که با هم به اندازه هفت عنصر فاصله دارند، خواص مشابهی از خود نشان میدهند.[2] این وضعیت،
برای نیولندز قاعده حاکم بر نتهای موسیقی را تداعی میکرد؛ در دنیای موسیقی برای همه صداها
هفت نت وجود دارد و در یک پهنه گسترده از صداها، این مجموعه هفتتایی تکرار میشود. بنابراین نام و
صدای نتهایی
که با هم به اندازه 7 نت فاصله دارند، مشابه است و تنها در فرکانس صدا متفاوتند.
به فاصله میان این نتهای همنام، اوکتاو گفته میشود. به این ترتیب نیولندز، قانون خود
را قانون اوکتاو11 نامید. به هر حال، این قانون تنها تا کلسیم برقرار
بود.

پدر جدول تناوبی امروزی کیست؟
لوتار مییر12 و دیمیتری مندلیف شیمیدانانی بودند که بهطور جداگانه و
همزمان، به نتایج مشابهی درباره طبقهبندی عنصرهای شیمیایی دست یافتند.
کتاب لوتار مییر در سال 1864، نسخه خلاصهشدهای از یک جدول را
دربرداشت که در آن عنصرها طبقهبندیشده بودند. مییر که این عنصرها را براساس افزایش جرم اتمی مرتب کرده بود
نشان داد که ظرفیت عنصرها بهعنوان تابعی از جرم اتمی، بهطور دورهای تغییر میکند. در سال 1868 او یک نسخه کامل از
این جدول را برای ارزیابی به دانشگاه ارائه داد اما بخت با مییر یار نبود و جدول
مندلیف یک سال زودتر توسط انجمن علمی در دسترس عموم قرار گرفت در حالی که جدول مییر در سال 1870
رونمایی شد.[3]
مندلیف در جریان نوشتن کتابی درباره
شیمی معدنی، عنصرهای شناخته شده با خواص یکسان را در یک گروه قرار داد. بخش نخست
این کتاب به شیمی هالوژنها اختصاص داشت. او سپس به شیمی عنصرهای فلزی پرداخت و آنها را با توجه به میل
ترکیبیشان
طبقهبندی
کرد؛ در آغاز فلزهای قلیایی که میل ترکیبی (ظرفیت)1
را به آنها
نسبت داد، سپس فلزهای قلیایی خاکی با میل ترکیبی2 و... . در این مسیر طبقهبندی عنصرهایی همچون
مس و جیوه دشوار بود زیرا گاه میل ترکیبی1 نشان میدادند و گاهی میل ترکیبی2 داشتند.
هنگام رفع این مشکل بود که متوجه شد در
مجموعههای
سهتایی
شامل هالوژن ـ فلز قلیایی ـ فلز قلیایی خاکی، الگوهایی
مشابه در خواص و جرمهای
اتمی تکرار میشود.
او در سه مجموعه [Cl-K-Ca]
،[Br-Rb-Sr]
و [I-Cs-Ba]
تغییر خواص مشابهی با افزایش جرم اتمی مشاهده کرد. سپس برای بررسی گستردگی این
الگو در عنصرهای دیگر تصمیم گرفت برای هر یک از 63 عنصر آن زمان کارت درست کند.
روی هر کارت اطلاعات آن عنصر شامل نماد، جرم اتمی و خواص فیزیکی و شیمیایی درج شد.
وقتی همه کارتها
آماده شد، مندلیف آنها
را بر اساس افزایش جرم اتمی عنصرهای گروهبندی شده ردیف کرد. آنچه پیش رویش قرار
گرفت جدول تناوبی بود که از روی آن موفق به ارائه قانون تناوبی شد. مندلیف طرح
جدول تناوبی خود را در سال 1869 منتشر کرد اما این آغاز راه بود؛ هنوز چالشهایی را پیشرو داشت. از جمله
اینکه مقدار تعیینشده
برای جرم اتمی عنصرها چندان صحیح نبود. از اینرو مندلیف عنصرها را به جای درنظر گرفتن
جرمهای
اتمی، براساس شباهت در خواص مرتب کرد. در نتیجه، بریلیم ـ که به اشتباه جرم اتمی
14 به آن نسبت داده شده بود ـ در گروه فلزهای قلیایی خاکی قرار گرفت. در مجموع،
برای 17 عنصر دیگر چنین جابهجاییهایی باید صورت میگرفت که خود نشانهای از وجود خطا در مقدار جرمهای اتمی بود.

از آنجا که انتخاب جرم اتمی بهعنوان معیار طبقهبندی، درست نبود حتی
پس از اصلاح مقدار جرمهای اتمی باز هم لازم بود جای برخی عنصرها به محلی غیر از آنکه
جرم اتمی تعیین کرده بود، تغییر یابد. گاه در اثر این جابهجاییها، خانههایی هم در جدول، خالی میماند که مندلیف آنها را به عنصرهایی
نسبت داد که هنوز کشف نشده بودند. به این ترتیب وجود 10 عنصر گم شده (شناخته نشده)
همراه با خواصشان
پیشبینی
شد. گذشته از اینکه جدول مندلیف زودتر از جدول مییر منتشر شد، همین رویکرد درباره
عنصرهای ناشناخته و خواص آنها، کار مندلیف را بر مییر برتری بخشید.
به هر حال مقدم دانستن اصل تشابه خواص
بر مقدار جرم اتمی در مورد تعیین محل سه جفت عنصر Ar-K ،Co-Ni و Te-I کاستی جدول مندلیف
بهشمار
میرفت
و نشان میداد
در نظر گرفتن قانون تناوبی بهعنوان تابعی از جرم اتمی، با نارساییهایی همراه است. بنا به مقدار جرمهای اتمی، مندلیف
باید جای دو عنصر هر جفت را در جدول با هم عوض میکرد اما در این صورت هم به تشابه خواص
عنصرهای یک گروه خدشه وارد میشد:
جدول مندلیف در مسیر تغییر
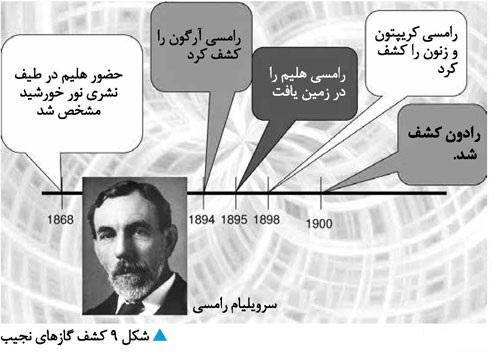
حدود سه دهه بعد، لرد رایلی13
کشف آرگون را گزارش داد و ثابت کرد که از نظر میل ترکیبی، عنصری خنثی است؛ عنصری
که مندلیف هیچ جایی برای آن در نظر نگرفته بود! سه سال بعد، در سال 1898 ویلیام
رامسی14 پیشنهاد کرد که بین Cl
و K یک خانواده جدید درنظر گرفته شود و
آرگون بهعنوان
همخانواده
هلیم در آن قرار گیرد. در اینجا بود که یکی از جفتهای ناسازگار جدول مندلیف، یعنی Ar-K ظاهر شد: جرم اتمی پتاسیم از آرگون کمتر بود در حالی که پس از آن
در جدول قرار میگرفت.
این مشکلی بود که باید گذشت زمان و درک ساختار اتم، آن را حل میکرد.
با توجه به میل ترکیبی و خنثی بودن
عنصرهای این گروه، ظرفیت صفر به آنها نسبت داده شد و دانشمندان این گروه را گروه صفر نامیدند.[1]
توضیح قانون تناوبی
با اینکه جدول مندلیف نیاز طبقهبندی عنصرها را به
خوبی برآورده میکرد
اما ذهن دانشمندان را با مشکل دیگری درگیر کرده بود: قانون تناوبی از کجا سرچشمه
میگیرد
و چرا تا این حد بینقص
عمل میکند؟
توضیح دلیل تناوبی بودن خواص عنصرها،
دانشمندان را تا قرن بیستم در انتظار گذاشت. در سال 1911 ارنست رادرفورد با آزمایش
پراکندگی پرتوی آلفا توسط هسته اتمهای سنگین، بار هسته را تعیین کرد و نشان داد که بار هسته با
جرم اتمی یک عنصر متناسب است. از سوی دیگر، وان دن بروک15 ایده ردیف
کردن عنصرها براساس عدد اتمی آنها را در جدول مطرح کرد که در سال 1913 با کار هنری موزلی مورد
تأیید قرار گرفت. موزلی طول موج خطوط طیفی پرتوی X
را برای برخی عنصرها تعیین کرد و نشان داد که به عدد اتمی عنصر بستگی دارد. به این
ترتیب درک جزئیات قانون تناوبی به کمک نظریه کوانتوم، طیفها و ساختار الکترونی اتم که با بررسیهای بوهر در سال 1922
آغاز شد، رفته رفته توسعه یافت و ایده استفاده از عدد اتمی به جای جرم اتمی را قوت
بخشید.[1و2] با استفاده از عدد اتمی جای هیچ عدم اطمینانی از درست بودن محل عنصرها
باقی نماند. کشف ایزوتوپها نیز نشان داد که ارزش جرم اتمی برای تعیین محل عنصرها در
جدول بسیار ناچیز است. اگر بخواهیم ایزوتوپهای یک عنصر را ـ که دارای جرمهای اتمی متفاوتند ـ
در جدول مندلیف قرار دهیم باید چگونه عمل کنیم؟ این پرسشی است که با بهکار بردن عدد اتمی
جایی برای طرح آن نمیماند زیرا عدد اتمی ایزوتوپهای یک عنصر یکسان است پس همه آنها خانهای واحد در جدول
خواهند داشت.
جدول مندلیف، از زمان ارائه آن تاکنون
تغییرات بسیار دیده است. بخشی از این تغییرات مربوط به افزوده شدن عنصرهای جدید به
آن بوده است اما بخش دیگر اصلاحاتی است که دانشمندان برای چگونگی نمایش گروه یا
ردیفها
در آن اعمال کردهاند.
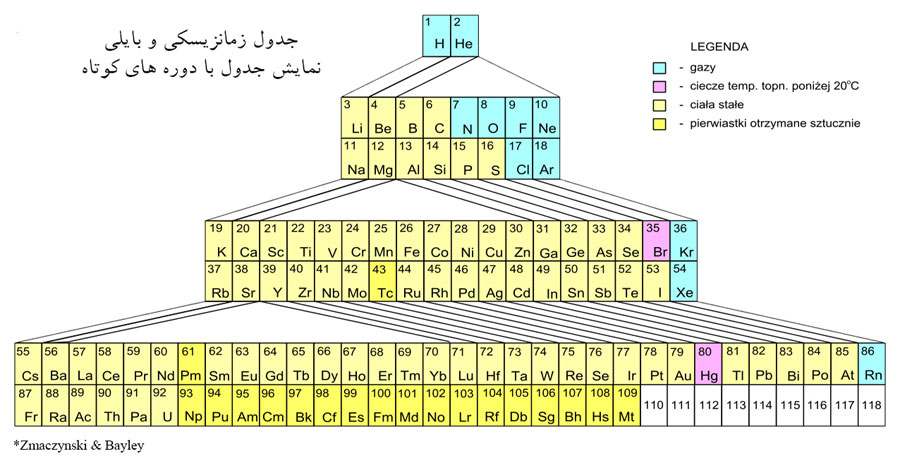
برای نمونه، جدول پیشنهادی بایلی16،
7 ردیف به این شرح را در بر میگرفت:
ـ یک ردیف با دو عنصر
ـ دو ردیف هر یک شامل هشت عنصر
ـ دو ردیف هر یک شامل هجده عنصر
ـ یک ردیف با 32 عنصر
ـ یک دوره کامل نشده، شکل 10.[1]
اشکال وارد بر این جدول، طولانی و
درنتیجه، جاگیر بودن ردیف 32 عنصری آن بود. در سال 1905 ورنر17 این
ردیف را با تقسیم آن به دو بخش، کوچکتر کرد.[1]
پس از ترتیب عنصرها براساس عدد اتمی،
آخرین تغییر در جدول تناوبی امروزی از سوی گلن سیبورگ18 انجام گرفت. او
در سال 1940 اورانیم را کشف کرد که در نتیجه آن، موفق شد عنصرهای بعدی با عدد اتمی
94 تا 102 را نیز کشف کند. [3] سیبورگ با قرار دادن مجموعه اکتینیدها زیر
لانتانیدها جدول تناوبی را بازآرایی کرد و در سال 1951 به پاس این اقدام خود، شایسته دریافت
جایزه نوبل شناخته شد.
پایان کلام
آنچه به جدول تناوبی امروزی، هویت یک
شاهکار بزرگ را بخشید، ساکنان آن یعنی عنصرها بودند. داستان کشف هریک از عنصرها با
گسترهای
از فعالیتها
در سرتاسر تاریخ این علم همراه بوده است از کیمیاگران، فلزکاران و صنعتگران تا همه
افرادی که به گونهای
با اصول و نظریههای
شیمی، مواد، روشهای
استخراج، پالایش و شناسایی آنها سروکار داشتهاند. پس در یک نگاه، باید جدول تناوبی را چکیدهای از کار همه شیمیدانان در طول تاریخ
دانست.
در سال جاری میلادی، از زمان تولد قانون
تناوبی یک قرن و نیم میگذرد. با این همه، در نتیجه تداوم فعالیتهای شیمیدانان بود که در سراسر تاریخ شیمی امکان
ظهور این قانون و در پی آن، برپایی جدول تناوبی عنصرها و حتی اصلاح و تغییر آن به
شکل امروزی را فراهم کرد.
اقدام به طبقهبندی عنصرها فرصتی بود که معلومات کسب
شده و متون شیمی باقیمانده از روزگاران کهن چنان نظم یابند تا امکان سپردن آن به میراثداران این پهنه تضمین شود و به این ترتیب، شیمی بهعنوان دانشی همیشه
زنده جلوه نماید.
پینوشتها
1.
Brand, H.
2. Doberiner, J.
3. Law of triads
4. Dumas, J.B.
5. Gmelin, L.
6. Lenssen, E.
7. Von Pe ttenkofer, M.
8. Cooke, J.P.
9. Chan courtios, A.E.B
10. Newlands, J.
11. Law of octaves
12. Meyer, L.
13. Rayleigh, L.
14. Ramsey, W.
15. Von den Broek, A.
16. Bayley, T.
17. Werner, A.
18. Seaborg, G.
منابع
1. Periodic table of elements.
www.britannica.com.science
2. History of periodic table. www.
newworldencyclopedia.org>entry
3. A brief history of development of
periodic table. www.wou.edu.physi>perhist
4. Development of chemical symbols and
periodic table.
www.vanderkrogt.net>elements>chemistry-of-chemical-symbols-and-periodic-elementymology
تاریخ جدول تناوبی عنصرها