مقدمه
دانشآموزان
در کتاب علوم نهم و همچنین در کتاب شیمی
دهم و یازدهم، میزان واکنشپذیری
عنصرها، به ویژه فلزها را بررسی میکنند و تا حدودی با این دسته از واکنشهای اکسایش و کاهش آشنا میشوند. در پایه دوازدهم این مبحث با
عنوان الکتروشیمی بهطور
کامل مطرح میشود. آزمایشهای متعددی در کتابهای درسی در این زمینه پیشنهاد شده است.
مانند آزمایش قرار دادن تیغه روی، منیزیم و آهن در محلول مس II سولفات در کتاب علوم نهم ( فصل اول)، آزمایش میخ آهنی با محلول مس
II سولفات در کتاب شیمی یازدهم (فصل اول)،
آزمایش استخراج آهن، زورآزمایی شیمی و برقکافت محلول در کتاب آزمایشگاه علوم. یکی
از آزمایشهای جالب زورآزمایی
شیمی نامیده شده است. دانشآموز
با اضافه کردن محلول مس II
کلرید به قوطیهای نوشیدنی ،پس از
چند دقیقه به راحتی قوطی را پاره میکند.
در این آزمایش با کنار زدن روکش پلاستیکی
در داخل قوطی نوشیدنی، امکان واکنش فلز آلومینیم با یون مس فراهم میشود. اگر به جای محلول مس کلرید از
محلول مس II سولفات در آب مقطر استفاده شود، زمان زیادی
باید سپری شود تا بتوان قوطی را نصف کرد. در هر دو واکنش، فلز آلومینیم به یون مس
الکترون میدهد:
2Al +3 CuCl2→ 2AlCl3 + 3 Cu
2Al + 3 CuSO4→ Al2 (SO4)3 + 3 Cu
اما چرا در واکنش دوم سرعت بسیار پایین
است? اگر از آب یونزداییشده برای تهیه محلول مسسولفات استفاده کنید، واکنش اصلاً انجام
نخواهد شد. در صورت تهیه محلول مس سولفات با آب شیر هم سرعت واکنش خیلی کندتر
خواهد بود. با استفاده از مس II
کلرید، پس از 2 تا 3 دقیقه، رسوب سرخرنگ
مس در محلهایی که با چاقو خراش
دادهاید دیده میشود و پس از 5 دقیقه با اطمینان میتوانید با یک پیچش، قوطی را نصف کنید. گفتنی است که در حالت اول، نیم ساعت
زمان لازم است تا بتوان قوطی را نصف کرد.
آزمایش کنید
مواد و وسایل مورد
نیاز:
بشرmL 25، گرد آگار،آب یونزداییشده،
ورقه آلومینیمی، پتری، مس II
سولفات، سدیمکلرید، مس II کلرید، مس II برمید.
گرد آگار را میتوانید
از شیرینیفروشیها تهیه کنید.

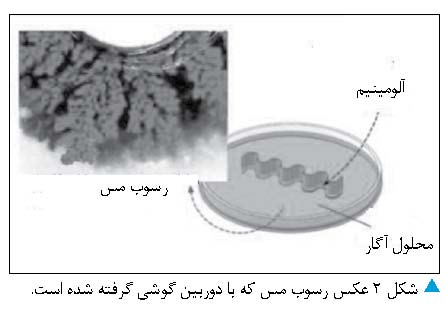
آزمایش 1
-mL 25 آب یونزداییشده در بشر بریزید و به آن 1 گرم گرد
آگار بیفزایید.
- بشر را تا دمای °C
90 گرم کنید و محتویات آن را به هم بزنید تا آگار کاملاً در آب حل شود.
- 2 گرم مس II سولفات، به بشر بیفزایید.
با لمس بشر به دمای محلول توجه کنید.
- محلول شفاف آبیرنگ
را در ظرف پتری بریزید و تکهای
از ورقه آلومینیم را داخل آن قرار دهید.
- به دمای محلول پس از چند دقیقه توجه
کنید. آیا تغییری در اطراف آلومینیم مشاهده میکنید؟
- با استفاده از دوربین گوشی همراه میتوانید در پنج دقیقه نخست آغاز واکنش، و
سپس نیم ساعت پس از قرار دادن آلومینیم، از ظرف پتری عکس بگیرید. ظرف پتری را برای
مقایسه با آزمایش دوم نگه دارید.
آزمایش 2
- دو مرحله نخست از آزمایش 1 را تکرار
کنید.
- 2 گرم مس II سولفات و 5/0 گرم نمک سدیمکلرید
به محلول آگار بیفزایید. با لمس بشر، به دمای محلول توجه کنید.
- محلول شفاف آبیرنگ
را در ظرف پتری بریزید و تکهای
از ورقه آلومینیم را داخل آن قرار دهید.
- به دمای محلول پس از چند دقیقه توجه
کنید. آیا تغییری در اطراف آلومینیم مشاهده میکنید؟
- با استفاده از دوربین گوشی همراه در
پنج دقیقه آغاز واکنش، و نیم ساعت پس از قرار دادن آلومینیم، از ظرف پتری عکس
بگیرید. ظرف پتری را برای مقایسه با آزمایش اول و سوم نگه دارید.
واکنش در این آزمایش با افزایش نمک سدیمکلرید، به سرعت آغاز میشود و ظرف واکنش در نتیجه آزاد شدن
گرما، گرم میشود. ( دما از 20 به
50 درجه سلسیوس میرسد.)
آزمایش 3
- پس از تهیه محلول آگار به روش دو
آزمایش قبل ، 2 گرم مسII
کلرید به محلول آگار بیفزایید. با لمس بشر به دمای محلول توجه کنید.
- محلول شفاف آبیرنگ
را داخل ظرف پتری بریزید و تکهای
از ورقه آلومینیم مانند آزمایش قبل در آن قرار دهید.
- به دمای محلول پس از چند دقیقه توجه
کنید. آیا تغییری در اطراف آلومینیم مشاهده میکنید؟
- در پنج دقیقه آغاز، و نیم ساعت پس از
قرار دادن آلومینیم، از ظرف پتری عکس
بگیرید.
- سرعت انجام بلورهای قرمز در اطراف
آلومینیم را در هر سه آزمایش با هم مقایسه کنید. چه عاملی در این سه آزمایش متفاوت
بود؟ وجود چه ذرهای میتواند باعث متفاوت شدن سرعت در این سه
ظرف شود؟
آزمایش 4
مراحل آزمایش 3 را با مس II برمید تکرار کنید.
چرا آلومینیم با مسII کلرید به سرعت وارد واکنش میشود ولی با مس II سولفات واکنش نمیدهد؟
این پدیده جالب توسط کلیف شرادر1 کشف
شد. او میخواست واکنش آلومینیم
با مسکلرید را انجام دهد
ولی قوطی مس کلرید خالی بود. بنابراین تصمیم گرفت از مس سولفات که به مقدار زیاد
در آزمایشگاه موجود بود استفاده کند. اما هیچ واکنشی رخ نداد. در هر دو واکنش،
تبادل الکترون بین مس و آلومینیم انجام میگیرد
در حالی که یونهای کلرید و سولفات،
نقش یونهای ناظر را دارند:
Al(s) → Al3+(aq) + 3e-
Cu2+(aq) + 2e- → Cu(s)
2Al(s) + 3Cu2+(aq) → 2Al3+(aq) + 3Cu(s)
هنوز هم معمای شرادر پاسخ روشنی ندارد. اما
توضیحاتی به شرح زیر در منابع مطرح شده است:
1. یون کلرید میتواند
نقش یک کاتالیزگر را داشته باشد. شرادر یونهای
هالید دیگر را بررسی کرد. با مس II برمید نیز واکنش به سرعت انجام شد. از این
پدیده به اثر تندشونده با هالید2 یاد میشود.
2. توجیه دیگر بر پایه لایه آلومینیماکسید تکیه دارد. اکسید آلومینیم تشکیلشده در سطح آلومینیم، مانند پوششی مانع
از واکنش آلومینیم با مواد میشود.
در شرایط اسیدی ( pH<4)
و شرایط بازی (pH>9)
این لایه اکسید حل میشود
و فلز آلومینیم زیر آن امکان انجام واکنش
را پیدا میکند. بنا به آزمایشها، یون کلرید و برمید سرعت واکنش
جانشینی Cu-Al را بهطور
معنیداری افزایش میدهند. به نظر میرسد،
در حضور یون کلرید، لایه اکسید حل میشود
و بنابراین آلومینیم با یون مس تماس پیدا میکند.
در منابع اشاره شده است که برای حل شدن این لایه pH کمتر از 4 لازم است. در حالی که محلول 1935/0 مول بر لیتر CuCl2 که دارای pH برابر 899/3 است و همچنین محلول 0387/0 مول بر لیتر آن با pH برابر 154/4، هر دو با آلومینیم به سرعت
واکنش میدهند. سوبل3 بر این باور است که یون هالید با یون آلومینیم
کمپلکس تولید میکند و با خارج کردن
این یون، سرعت واکنش رفت افزایش مییابد.
Al2O3+4Cl-+H2O+2H+→ 2 [Al (OH)2Cl2]-
واکنش همچنین با آزاد شدن گاز هیدروژن
همراه است:
2Al+ 6H+→ 2Al3++ 3H2

نتیجهگیری
یونهای
تماشاچی در برخی از واکنشها،
روی سرعت واکنش اثر میگذارند.
برای نمونه یون هالید در واکنش جابهجایی
Cu-Al سرعت واکنش را بیش از دو برابر، نسبت به یونهای سولفات و نیترات افزایش میدهد.
پینوشتها
1.Schrader,C.
2.
A halid-acceleration effect
3.Sobel,S.G.
منابع
1.Sobel,
S.G. and Cohen S. ,J.Chem. Educ.2010,
87, No. 6 June.
2.Wei,
W.Y, Lee, C. and Chen, H.J. "Modeling and Analysis of the Cementation
Process on a Rotating Disk." Langmuir 1994, 10, 1980-1986
3.Flinn
Scientific 2017, Content Standards: Grades 9–12 Content Standard
B: Physical Science, structure and properties of matter, chemical reactions,
Publication No. 10263
022117.
https://www.flinnsci.com/api/library/Download/c2f239d8c3b74706972220d18f166cac
4.Xu
Xinhua, at ale, J. Chem. Educ,2016, May
22.
5.www.hofstra.edu/pdf/about/administration/provost/orsp/orsp_faculty_research2013_sobel.pdf
6.www.middleschoolchemistry.com/lessonplans/chapter6/lesson5